Pour de nombreuses raisons, la gravure domestique des PCB est en quelque sorte un art en voie de disparition. La raison principale est bien sûr l’essor des services de fabrication rapide de PCB ; quand vous pouvez envoyer vos Gerbers et recevoir une boîte contenant une douzaine de PCB fabriqués par des professionnels pour quelques dollars, pourquoi voudriez-vous vous embêter à graver les vôtres ?
La commodité et le coût mis à part, il existe une tonne de raisons valables de créer vos propres planches, allant de ne pas avoir à attendre l’expédition au simple désir de contrôler le processus vous-même. Quel que soit le camp dans lequel vous vous trouvez, il est utile de savoir ce qui se passe lorsque votre simple carte recouverte de cuivre, ornée de vos précieuses œuvres d’art, se glisse dans le réservoir de gravure et devient un circuit imprimé. Que se passe-t-il exactement là-dedans pour retirer le cuivre ? Et comment la méthode de gravure affecte-t-elle le produit final ? Jetons un coup d’œil à quelques-unes des méthodes de gravure les plus populaires pour comprendre la chimie derrière vos cartes.
Humide, sec ou entre les deux ?
En fin de compte, la gravure de PCB consiste à retirer le cuivre d’une carte de la manière la plus contrôlée possible. Les méthodes de gravure des PCB appartiennent généralement à l’une des deux grandes catégories suivantes : les procédés humides et secs. Pour le joueur amateur, les processus secs incluraient des méthodes telles que le fraisage des traces avec un routeur CNC, ou même la méthode éprouvée consistant à gratter les traces à l’aide d’une lame de rasoir. Au niveau commercial, la gravure sèche fait généralement référence à des méthodes telles que la gravure au laser, où un laser haute puissance est utilisé pour enlever le cuivre du substrat sous-jacent afin de créer des traces, ou la gravure au plasma, qui utilise l’énergie RF pour générer un plasma réactif à partir d’une gravure. gaz.
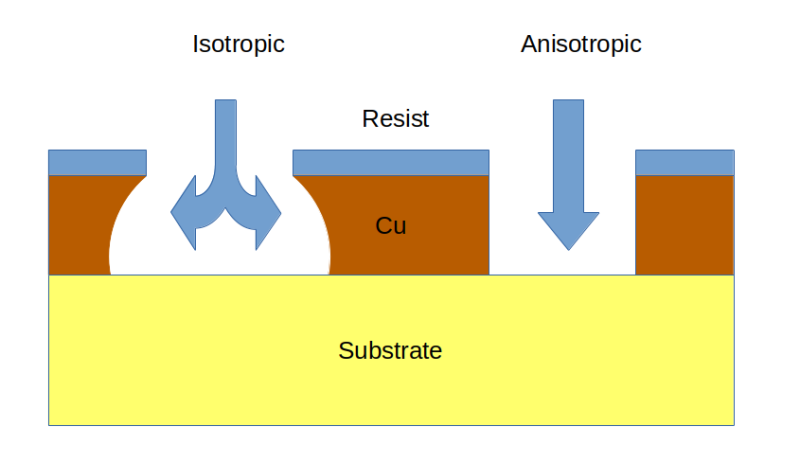
À l’exception notable du grattage des traces avec un X-Acto, ces méthodes de gravure sèche présentent toutes l’inconvénient de nécessiter des machines spécialisées. Ce qui leur manque en termes de simplicité, cependant, est compensé par la direction de la gravure et le contrôle fin qu’ils obtiennent lors de l’élimination du cuivre. Les méthodes de gravure sèche sont toutes des processus anisotropes ; c’est-à-dire qu’ils dirigent l’élimination du cuivre dans une seule direction et évitent le risque de sous-cotation. Les méthodes humides, qui reposent toutes sur des réactions chimiques pour introduire le cuivre métallique dans une solution aqueuse, sont des processus isotropes, ce qui signifie qu’ils se déroulent plus ou moins uniformément dans toutes les directions. Cela peut devenir un problème ; si le processus n’est pas étroitement contrôlé, les réactions de gravure peuvent s’étendre sous la couche de réserve, masquant les zones des futures traces du PCB, créant potentiellement un rétrécissement des traces à haute résistance ou même des circuits ouverts.
Chlorure ferrique
Si vous avez déjà gravé des PCB à la maison, il y a de fortes chances que vous ayez au moins essayé l’ancien chlorure ferrique de secours. C’est bon marché et facile, et présente de nombreux avantages par rapport aux autres produits chimiques de gravure humide, le moindre étant que vous pouvez en fabriquer une quantité presque illimitée en utilisant rien d’autre qu’une poignée de clous et certains produits chimiques que vous pouvez facilement vous procurer dans une piscine. magasin et une pharmacie :
Également connu sous le nom de chlorure de fer (III) (FeCl3), le chlorure ferrique dissout rapidement et efficacement le cuivre métallique, mais à quoi ressemble la réaction ? La réaction globale est assez simple :
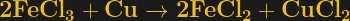
Lorsque le chlorure ferrique entre en contact avec du cuivre métallique, l’un de ses atomes de chlore est transféré à un atome de cuivre, produisant du chlorure de cuivre (II), ou chlorure cuivrique, soluble dans l’eau. Cela permet au cuivre qui était autrefois lié au substrat PCB d’être rincé. Cela semble assez simple, mais cette réaction globale cache une grande complexité chimique, et les détails méritent d’être approfondis un peu.
Tout d’abord, un peu de nomenclature. Les composés contenant des cations métalliques (espèces chargées positivement) utilisent traditionnellement différents suffixes pour désigner leur état d’oxydation ou la charge de l’atome. Le suffixe « -ic » désigne l’état d’oxydation supérieur, tandis que « -ous » fait référence à l’état d’oxydation inférieur. Le suffixe est ajouté au préfixe latin du métal, donnant des noms tels que « ferrique », faisant référence au fer avec un état d’oxydation 3+, ou « ferreux », qui est un état 2+. Cette convention remonte presque à l’époque de l’alchimie, et bien qu’elle soit encore d’usage courant, la nomenclature standard consiste désormais à indiquer l’état d’oxydation avec des chiffres romains entre parenthèses dans les noms de composés, chlorure de fer (III) (FeCl3) et du chlorure de fer (II) (FeCl2).
La nomenclature ouvre la voie à la compréhension des réactions sous-jacentes qui rendent le chlorure ferrique efficace pour graver le cuivre. En solution, le chlorure ferrique se dissocie rapidement en ions fer (III) et chlorure :
 (équation 1)
(équation 1)
De même, l’eau se dissocie en ions hydrogène et hydroxyle :
 (équation 2)
(équation 2)
Cela se traduit par une abondance d’ions fer (III) avec une forte charge positive dans un environnement contenant beaucoup d’ions hydroxyles chargés négativement. Ils se rassemblent et forment de l’hydroxyde de fer (III), qui est un composé insoluble qui précipite hors de la solution :
 (équation 3)
(équation 3)
Retirer tous ces ions hydroxyle de la solution laisse un tas d’ions hydrogène, ce qui a pour effet de rendre la solution plus acide (diminution de son pH). Cela crée un environnement dans lequel les ions de fer (III) de l’équation 1 gagnent un électron (réduction) à partir de la gaine de cuivre solide du PCB, ce qui entraîne une oxydation du cuivre en ions cuivre (II) en solution :
 (équation 4)
(équation 4)
Les ions cuivre (II) et fer (II) en solution sont alors libres de se glomer sur tous les ions chlorure hautement électronégatifs de l’équation 1, formant les produits chlorure de cuivre (II) et chlorure de fer (II) sur le côté droit de l’ensemble. équation, et en laissant derrière elle des zones sans cuivre sur le PCB nouveau-né. La solution de gravure finit par être saturée d’oxyde de cuivre (II), qui commence à précipiter hors de la solution sous la forme d’un solide bleu-vert. Il faut cependant un certain temps pour y arriver ; En fonction de la force de l’agent de gravure lorsqu’il est frais, vous pouvez vous attendre à ce qu’il contienne jusqu’à 50 grammes par litre de cuivre métallique avant de ne plus pouvoir en contenir.
Persulfates
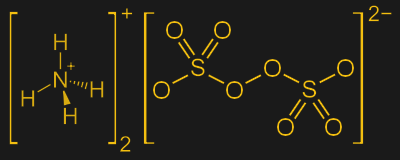
Une autre méthode de gravure humide souvent utilisée par les amateurs est la méthode au persulfate. En général, les persulfates sont de puissants oxydants, grâce à la liaison oxygène-oxygène entre les deux groupes sulfate. Cela fait du persulfate un peroxyde, comme le peroxyde d’hydrogène plus connu, où le double oxygène présente un bon site accepteur pour les électrons.
Les persulfates sont généralement disponibles sous forme de sels de sodium ou d’ammonium, voire parfois même de potassium. Ces espèces chargées positivement sont appelées contre-ions ; lorsqu’ils sont dissous dans l’eau, les sels persulfates se dissocient rapidement en ions persulfate libres et leurs contre-ions :
![\bf \gauche[NH_{4}\right]^{+}_{2}\gauche[S_{2}O_{8}\right]^{2-} \rightleftharpons 2 \left[NH_{4}\right]^{+} + \gauche[S_{2}O_{8}\right]^{2-}](https://10-raisons.com/wp-content/uploads/2023/08/1693514089_941_Fini-le-cuivre-la-chimie-derriere-la-gravure-des-PCB.png)
Les contre-ions flottent en quelque sorte et ne participent pas sérieusement à la réaction de gravure suivante ; ils s’occupent simplement de se lier vaguement aux ions persulfate et de retomber dans une danse constante d’équilibre. La véritable action se situe au niveau des persulfates, qui sont prêts à agir sur le cuivre métallique.
Contrairement au chlorure ferrique, la réaction globale entre les persulfates et le cuivre représente à peu près toute l’histoire :
![\bf Cu_{(solide)} + \left[S_{2}O_{8}\right]^{2-} \rightarrow Cu^{2+} + 2 \left[SO_{4}\right]^{2-}](https://10-raisons.com/wp-content/uploads/2023/08/1693514089_565_Fini-le-cuivre-la-chimie-derriere-la-gravure-des-PCB.png)
Lorsque les ions persulfate entrent en contact avec du cuivre solide, le métal cède volontiers des électrons à la liaison peroxyde, réduisant ainsi la liaison et divisant le persulfate en deux ions sulfate tout en solubilisant le cuivre. Le cuivre dissous se lie ensuite à l’un des ions sulfate pour former du sulfate de cuivre (II), ce qui confère à la solution d’attaque au persulfate une teinte bleu-vert familière au fur et à mesure de la gravure.
Chlorure cuivrique
Un autre agent de gravure populaire auprès des brasseurs amateurs et des fabricants commerciaux est le chlorure cuivrique, ou, en utilisant la nomenclature actuellement acceptée, le chlorure de cuivre (II). Il peut sembler un peu étrange qu’un agent de gravure pour le cuivre contienne lui-même du cuivre, mais le chlorure cuivrique attaque rapidement et à moindre coût et présente l’avantage de se régénérer.
Bien qu’il soit possible d’acheter (ou de fabriquer) simplement une solution de chlorure cuivrique en traitant des déchets de cuivre avec de l’acide chlorhydrique, il est plus facile de simplement jeter tous les ingrédients avec le PCB à graver et de laisser le cuivre sur la carte remplacer les déchets de cuivre. . La réaction globale est assez simple, mais encore une fois, elle cache une complexité chimique intéressante :

Le chlorure cuivrique attaque le cuivre métallique du PCB, produisant ainsi deux molécules de chlorure cuivreux soluble. Assez simple, mais d’où vient le chlorure cuivrique en premier lieu ? Nous avons besoin d’un moyen de dissoudre un peu de cuivre du panneau et de le faire réagir avec des ions chlorure. Cela se fait généralement avec un mélange d’acide chlorhydrique et de peroxyde d’hydrogène. Premièrement, le peroxyde d’hydrogène se décompose en eau et en un radical oxygène, tandis que l’acide chlorhydrique se dissocie en ions hydrogène et chlorure :


Il s’agit d’un mélange assez puissant, le radical oxygène et les ions chlorure attaquant le cuivre métallique solide et formant un complexe connu sous le nom de tétrachlorocuprate :
![\bf O\cdot + 2 H^{+} + Cu_{(solide)} + 4 Cl^{-}\rightarrow H_{2}O + \left[CuCl_{4}\right]^{2-}](https://10-raisons.com/wp-content/uploads/2023/08/1693514089_906_Fini-le-cuivre-la-chimie-derriere-la-gravure-des-PCB.png)
Le complexe chlore-cuivre est capable d’oxyder directement le cuivre, ce qui crée le chlorure cuivrique qui va ensuite effectuer l’essentiel de la gravure :
![\bf \gauche[CuCl_{4}\right]^{2-} + Cu_{(solide)} \rightarrow 2CuCl_{2}](https://10-raisons.com/wp-content/uploads/2023/08/1693514089_696_Fini-le-cuivre-la-chimie-derriere-la-gravure-des-PCB.png)
Le principal avantage de la gravure au chlorure cuivrique est la régénération, qui peut être réalisée de plusieurs manières. Industriellement, du chlore gazeux barbote souvent à travers l’agent de gravure ; cela transforme le chlorure cuivreux en chlorure cuivrique sans diluer l’agent de gravure, mais ce n’est évidemment pas quelque chose que vous voudriez faire dans le laboratoire à domicile. Le perchlorate de sodium, autre agent oxydant puissant, est parfois utilisé industriellement, mais présente l’inconvénient de générer un précipité de chlorure de sodium dans l’agent de gravure qu’il faut éliminer. Il existe également des méthodes électrolytiques et électroosmotiques qui restaurent le chlorure cuivrique tout en récupérant le cuivre métallique, mais celles-ci sont évidemment compliquées.
Heureusement, le joueur à domicile dispose d’une méthode de régénération simple, qui utilise des produits chimiques que nous avons déjà ajoutés pour démarrer la réaction : de l’acide chlorhydrique et du peroxyde :

L’oxydation du chlorure cuivreux avec du peroxyde d’hydrogène en présence d’ions chlorure de l’acide chlorhydrique réinitialise efficacement la solution de gravure, restaurant le chlorure cuivrique et préparant la solution pour une nouvelle tentative sur le cuivre métallique solide. Cela produit cependant des molécules d’eau, donc la dilution est un problème, mais cela peut être compensé dans une certaine mesure en ajoutant plus d’acide. Il s’agit néanmoins d’un système plutôt soigné, d’un processus presque en boucle fermée, simple et bon marché.
Il manque évidemment de nombreux détails dans cette visite rapide, et il existe une tonne d’autres méthodes de gravure que je n’ai pas abordées. Mais quel que soit celui que vous choisissez d’utiliser, assurez-vous de prendre les précautions appropriées, de porter votre EPI et d’avoir un plan pour ce que vous allez faire avec les déchets.




































