Chaque fois que quelqu’un mentionne le mot « anticorps » ces jours-ci, il est sûr d’attirer votre attention. Les pensées vont généralement au système immunitaire humain et au rôle qu’il joue dans la pandémie actuelle de COVID-19, et à la façon dont notre corps combat la maladie en général. Le système immunitaire est extrêmement complexe, mais à peu près tout le monde sait que les anticorps en font partie et qu’ils sont essentiels à la capacité du corps à reconnaître et à neutraliser les envahisseurs comme les bactéries et les virus.
Mais aussi importants que soient les anticorps pour l’immunité à long terme et la prévention des maladies, c’est loin d’être tout ce à quoi ils sont bons. L’incroyable spécificité des anticorps contre leurs antigènes cibles en fait des outils puissants pour la recherche biologique et les diagnostics cliniques, comme les tests COVID-19 rapides. La spécificité des anticorps a également ouvert des modalités thérapeutiques qui appartenaient autrefois à la science-fiction, où des anticorps sur mesure agissent comme un missile guidé pour attaquer directement non seulement une protéine spécifique du corps, mais parfois même une partie spécifique d’un corps. protéine.
Pour que ces thérapies fonctionnent, cependant, il faut des anticorps spéciaux : des anticorps monoclonaux. Ces derniers ont fait l’actualité récemment, non seulement en tant que traitement possible du COVID-19, mais aussi pour tout traiter, de la polyarthrite rhumatoïde aux pires formes de cancer. Mais que sont exactement les anticorps monoclonaux, comment sont-ils fabriqués et comment fonctionnent-ils ?
Poly vs Mono
Il est utile d’avoir une idée générale du fonctionnement du système immunitaire avant de se plonger dans les spécificités des anticorps monoclonaux. Heureusement, les bases sont assez simples. En un mot, il existe deux systèmes d’immunité dans le corps humain : l’inné et l’adaptatif. Les deux sont composés de globules blancs spécialisés appelés lymphocytes. Le système immunitaire inné est un système « d’attaque rapide », capable de discerner rapidement l’ami de l’ennemi et de digérer les envahisseurs. Les restes de ces envahisseurs, principalement les fragments de leurs protéines, sont appelés antigènes, et ils sont présentés aux lymphocytes du système immunitaire adaptatif, qui sont parsemés d’anticorps appelés immunoglobulines. Ces anticorps sont une population très diversifiée de protéines qui représentent une mémoire chimique d’antigènes que le corps a rencontrés auparavant. Tout antigène qui correspond à un anticorps s’y liera, déclenchant une série d’événements qui provoquent une énorme accumulation de lymphocytes porteurs de cet anticorps, qui recherchent et détruisent ensuite l’envahisseur avec une grande spécificité.
Alors que les anticorps produits par le système immunitaire adaptatif sont hautement spécifiques d’un antigène particulier, ils ont encore une certaine « marge de manœuvre ». Les antigènes qui sont présentés au système immunitaire adaptatif sont en fait assez volumineux, et il est tout à fait possible que des anticorps existent contre différentes caractéristiques de la même protéine, appelées épitopes. C’est un avantage, car cela augmente la probabilité que le système immunitaire adaptatif soit capable de reconnaître l’antigène, peu importe à quel point il est haché par le système immunitaire inné. Il est également utile en cas de mutation du virus, ce qui pourrait modifier suffisamment un épitope pour ne plus être reconnu. Les anticorps dirigés contre plusieurs épitopes, appelés anticorps polyclonaux, fournissent une redondance et contribuent à augmenter les chances d’une réponse immunitaire robuste.
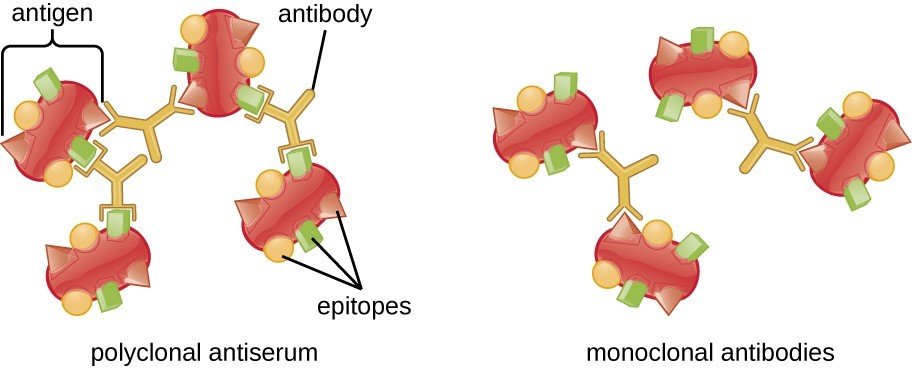
Alors que jusqu’à présent j’ai décrit le fonctionnement du système immunitaire dans votre corps, il est important de garder à l’esprit que les anticorps sont également des outils puissants pour la recherche et le diagnostic clinique. La capacité de créer une population d’anticorps qui peuvent se lier à une protéine spécifique a été une énorme aubaine pour la recherche biologique. La création d’anticorps implique généralement d’injecter l’antigène cible à un rat ou à une souris, de récolter les globules blancs de l’animal et de purifier les anticorps pour obtenir uniquement ceux qui se lient à l’antigène d’intérêt. C’est un processus qui nécessite beaucoup de temps — trois mois ou plus n’est pas rare — et beaucoup de compétences spécialisées. Le résultat final est un ensemble d’anticorps polyclonaux.
Alors que les techniques traditionnelles de production d’anticorps ont fait beaucoup de travail dans la recherche biomédicale au fil des ans, il arrive parfois que les anticorps polyclonaux qu’elles produisent ne soient tout simplement pas l’outil pour le travail. Dans certains cas, une plus grande spécificité de liaison est nécessaire, ce à quoi servent les anticorps monoclonaux. Les anticorps monoclonaux, souvent abrégés en « mAbs », sont des anticorps qui reconnaissent un seul épitope de l’antigène cible. Cela peut être un outil incroyablement puissant pour la recherche, car des anticorps peuvent être créés qui se lient à une seule région d’une grande protéine. Cela peut être utilisé pour explorer la fonction de cette région; par exemple, un anticorps monoclonal qui se lie uniquement à un épitope spécifique peut être utilisé pour sonder si cette région est un site de liaison pour une autre protéine en bloquant physiquement l’accès à celle-ci.
Des cellules cancéreuses rendues bonnes
Bien que le système immunitaire naturel soit essentiellement une usine d’anticorps polyclonaux, cela ne veut pas dire que les anticorps monoclonaux ne se manifestent pas naturellement. Malheureusement, ils sont le plus souvent observés chez les patients atteints de myélome multiple, un cancer du sang qui affecte les cellules sanguines impliquées dans l’immunité. Tous les cancers sont caractérisés par la surproduction d’un type de tissu particulier, et les cellules myélomateuses naturelles ont donné aux chercheurs un outil pour créer des populations massives de cellules identiques – des clones – qui produisent chacune un seul anticorps.
L’astuce, cependant, était de comprendre comment programmer les cellules de myélome pour produire un anticorps spécifique, et dans les années 1970, lorsque tout cela a été exploré pour la première fois, la biologie moléculaire en était encore à ses balbutiements. Les chercheurs ont donc dû bidouiller un peu pour que cela se produise. L’idée de base qu’ils ont eue était de fusionner des cellules de myélome immortelles avec des cellules portant des anticorps dirigés contre les antigènes d’intérêt. Ces cellules d’hybridome portent chacune les gènes d’un seul anticorps et peuvent être cultivées en abondance une fois le travail de création terminé.
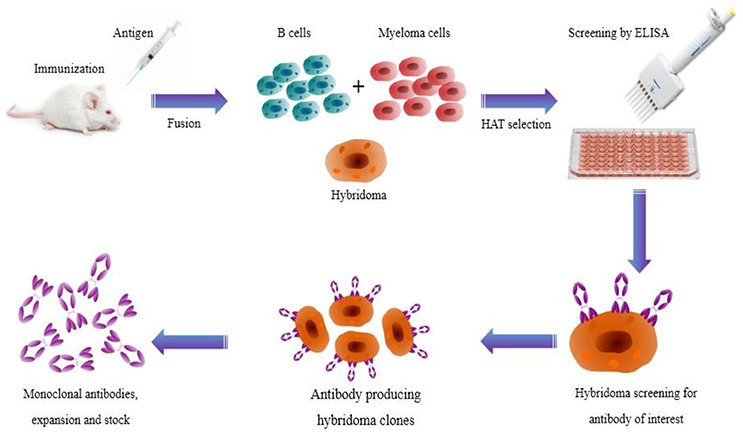
Les cellules d’hybridome sont difficiles à produire. Il y a d’abord le problème de la croissance de nombreuses cellules productrices d’anticorps, appelées cellules B, chez la souris ou d’autres mammifères. Ensuite, les cellules B doivent être fusionnées aux cellules myélomateuses, soit chimiquement en traitant les cellules avec du polyéthylène glycol, soit en utilisant un champ électrique. Il y a aussi le problème de séparer les quelques cellules qui fusionnent avec succès du myélome non fusionné et des cellules B. Ceci est accompli en utilisant des cellules de myélome qui sont sensibles à l’aminoptérine, un agent de chimiothérapie. Les cellules de myélome qui fusionnent avec succès seront «sauvées» par la version intacte du gène dans les cellules B et pourront vivre dans un milieu de croissance contenant le médicament.
L’astuce suivante consiste à transformer la population polyclonale de cellules d’hybridomes en un certain nombre de populations monoclonales. Cela se fait en diluant les cellules de fusion survivantes au point qu’en moyenne, il n’y a qu’une seule cellule dans un volume donné de milieu de croissance. Placer ce volume dans chaque puits d’une plaque de microtitration permet à la cellule unique de se développer, produisant une lignée cellulaire clonale qui porte les gènes pour créer des anticorps contre un seul épitope. Trouver la lignée cellulaire qui réagit avec un épitope spécifique consiste alors à cribler toutes les lignées d’hybridomes à l’aide de diverses méthodes immunochimiques, comme fixer l’antigène sur un substrat solide et l’utiliser pour lier uniquement les hybridomes qui lui sont spécifiques.
Au cours des décennies qui ont suivi l’exploration des techniques d’hybridome, de nombreuses autres méthodes de production d’AcM ont été développées. Le phage display, où les virus qui infectent les bactéries sont modifiés pour exprimer des anticorps sur leurs enveloppes protéiques, peut être utilisé pour cribler un grand nombre d’anticorps contre un antigène spécifique, puis disposer de l’ADN qui code pour les anticorps facilement disponible pour le clonage. Des souris transgéniques qui portent des gènes d’anticorps humains peuvent également être utilisées pour produire des bibliothèques d’AcM ; presque tous les anticorps monoclonaux thérapeutiques actuellement approuvés sur le marché aujourd’hui ont été développés via des souris transgéniques.
Les missiles guidés de la médecine
À partir de l’exemple ci-dessus d’utilisation d’AcM pour sonder les domaines de liaison sur des protéines, il s’agit d’un saut assez court pour voir comment ils peuvent être utilisés non seulement à des fins diagnostiques, mais thérapeutiques. La spécificité des anticorps monoclonaux rend les thérapies extrêmement ciblées, par opposition à, disons, prendre un médicament par voie orale et espérer qu’il soit transporté dans tout le corps jusqu’à la cible thérapeutique. C’est là que les anticorps monoclonaux tirent leur réputation bien méritée de « missiles guidés » de la médecine.
Cependant, la métaphore du missile commence à s’effriter un peu lorsque l’on considère le fonctionnement des thérapies par mAb. Lorsqu’un missile doit généralement lancer une ogive pour être efficace, en thérapie mAb, parfois le simple fait qu’ils puissent se lier à des protéines spécifiques est une arme suffisante. C’est particulièrement le cas avec les thérapies pour les maladies auto-immunes comme la maladie de Crohn et la polyarthrite rhumatoïde, où le système immunitaire du patient prend ses propres cellules pour des envahisseurs et commence à les attaquer.
Ces maladies sont traitées avec des mAb qui ciblent et se lient au facteur de nécrose tumorale alpha (TNF-α), une protéine qui régule le système immunitaire et empêche la cascade autodestructrice. Certaines thérapies contre le cancer utilisent une approche similaire, avec des mAb se liant à certaines protéines qui régulent la division cellulaire, les ciblant ainsi pour le nettoyage par le système immunitaire du patient.
Néanmoins, certaines thérapies par mAb portent également une charge utile vers leur cible. Dans certains cas, un radio-isotope peut être connecté au mAb pour délivrer une dose de rayonnement directement aux cellules cancéreuses ; d’autres mAbs peuvent délivrer avec une précision moléculaire soit des molécules médicamenteuses soit des molécules promédicament qui peuvent ensuite être converties en leur forme active.
Monoclonaux pour COVID
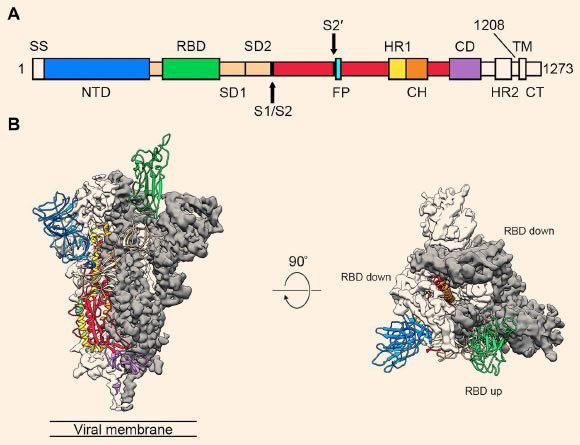
Tout cela nous amène à la pandémie actuelle et à la façon dont l’immunothérapie monoclonale est exploitée pour aider les patients COVID-19. La Food and Drug Administration des États-Unis a jusqu’à présent autorisé trois immunothérapies mAb pour COVID-19 dans le cadre d’autorisations d’utilisation d’urgence (EUA). Deux d’entre eux sont actuellement recommandés et sont utilisés pour les patients hospitalisés avec un COVID-19 léger à modéré. L’un est un cocktail de deux mAb, appelés casirivimab et imdevimab – vous pouvez dire qu’un médicament est un anticorps monoclonal par le –mab suffixe – ce qui est intéressant car, bien que chaque mAb se lie à la légendaire protéine de pointe du virus SARS-CoV-2, ils se lient chacun à des épitopes différents mais qui se chevauchent de la protéine.
Les deux épitopes se trouvent dans le domaine de liaison au récepteur (RBD) de la protéine de pointe, ce qui signifie qu’une fois que les mAb se lient aux protéines de pointe sur une particule virale en circulation, il n’est plus capable de se lier à son récepteur, le récepteur ACE-2 tapissant le épithélium des voies respiratoires. Le résultat est que le virus n’est plus capable d’entrer dans les cellules et de se répliquer, ce qui, espérons-le, réduit la charge virale et conduit à des récupérations plus rapides.
Pour le casirivimab/imdevimab, qui est commercialisé par Regeneron sous le nom de REGEN-COV, les chiffres semblent assez bons — donner le traitement mAb, qui est soit une perfusion IV soit un ensemble de quatre injections sous-cutanées, dans les dix premiers jours des symptômes réduit le risque qu’un cas léger à modéré de COVID progresse d’environ 70 %. Il a également des indications pour une utilisation prophylactique post-exposition pour les personnes immunodéprimées.
Les anticorps monocolonaux ont changé la donne dans la recherche biologique et dans le traitement d’un large éventail de maladies graves. Le développement de nouvelles techniques pour les rendre plus faciles à fabriquer devrait élargir leur utilisation en tant que missiles guidés de la médecine.




































